Alleviant Medical 赢得 FDA IDE 批准,取得无植入心力衰竭治疗的突破性进展
Alleviant Medical近日宣布,其创新型无植入心房分流装置获得了FDA的临床试验豁免(IDE)批准及突破性设备认定。该技术通过微创手术降低心房压力,为心力衰竭患者提供了一种全新的治疗选择,特别适用于射血分数降低型心力衰竭(HFrEF)和射血分数保留型心力衰竭(HFpEF)。这一里程碑式的进展不仅展示了公司在心血管领域的技术革新,也为解决未被满足的临床需求带来了新的可能。
关于心力衰竭诊疗
高患病率与复杂性
心力衰竭是一种全球范围内高发病率、高死亡率的慢性疾病,目前影响超过2600万名患者。其主要特征是心脏无法有效泵出足够的血液以满足身体的代谢需求,导致一系列症状,包括气促、疲劳以及严重的活动能力受限。

两大主要亚型
根据左室射血分数(LVEF)的不同,心力衰竭通常分为以下两类:
射血分数降低型心力衰竭(HFrEF):因心肌收缩功能受损,LVEF低于40%。
射血分数保留型心力衰竭(HFpEF):尽管心肌收缩功能正常,但心室舒张期充盈受限,同样导致心排血量不足。
现有治疗手段的局限性
尽管药物、植入设备和外科干预等治疗方式为部分患者提供了帮助,但仍存在局限性:
HFpEF患者:目前缺乏针对性的有效治疗方法。
HFrEF患者:即使接受标准药物或设备治疗,许多患者仍存在明显症状,并且频繁住院风险较高。
因此,实现一种兼具安全性、疗效和广泛适用性的突破性创新疗法,已成为当前心力衰竭治疗领域的核心挑战。
关于无植入心房分流装置
原理与操作机制
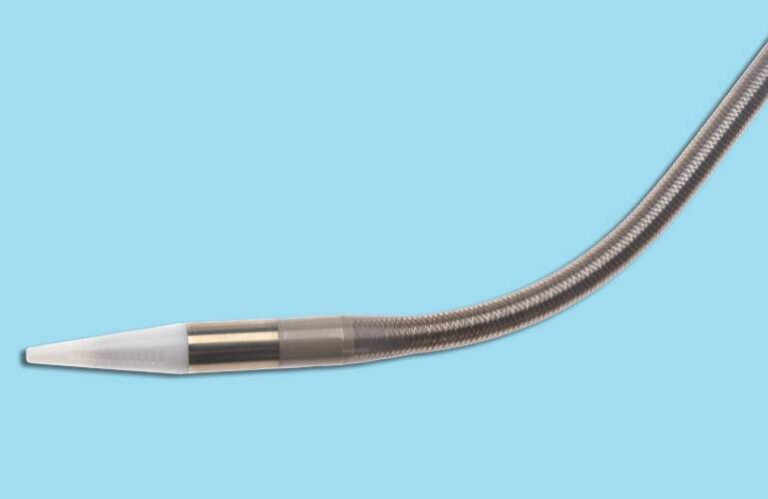
Alleviant Medical的无植入心房分流装置是一种基于导管的微创疗法,通过调节心房之间的压力差来缓解心力衰竭的症状:
生物通道创建
经导管进入左心房,通过能量脉冲在房间隔上形成一个永久性的开口,将左心房与右心房连接起来。
压力转移和平衡
左心房中的高压血液流向右心房,从而有效降低左心房压力,减轻肺静脉淤血并优化血流动力学。
无植入设计
与传统植入式设备不同,该方法无需长期植入任何器械,从而避免感染、移位或器械故障等相关并发症。
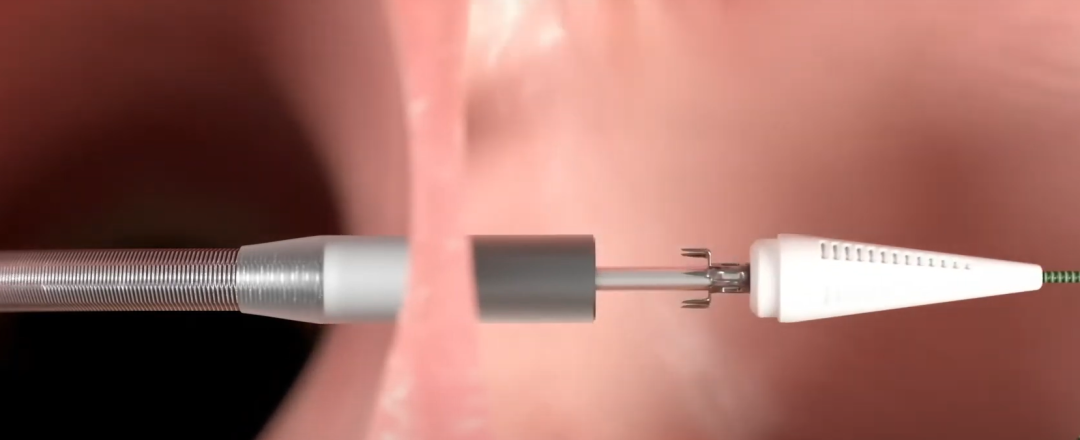
产品核心优势
无植入心房分流装置具备以下显著优势:
无植入设计:规避了传统植入器械的长期安全隐患,如感染、血栓或设备故障。
微创手术:通过经导管完成,手术时间短、创伤小,术后恢复更快。
广泛适用性:覆盖HFrEF和HFpEF两类患者,为更多心力衰竭群体提供有效治疗方案。
改善远期预后:通过降低左心房压力,可减少急性事件发生,提高生活质量,并可能延长生存期。
FDA的监管支持
突破性设备认定:作为一种创新设备,该装置专为 HFrEF 和 HFpEF 两类心力衰竭患者设计,无植入心房分流装置获得了FDA的突破性设备资格(Breakthrough Device Designation),加速了审批流程。
IDE批准:此次FDA授予的临床试验豁免(IDE)许可,为关键性临床试验ALLAY-HFrEF提供了必要的法律依据,这意味着该装置正式进入验证阶段。
ALLAY-HF试验多中心初步可行性研究:
目标患者:HFpEF患者
实验时间:6个月
实验目的:探索装置对 HFpEF 患者的疗效,并进一步完善其广泛适用性的证据。
实验结果
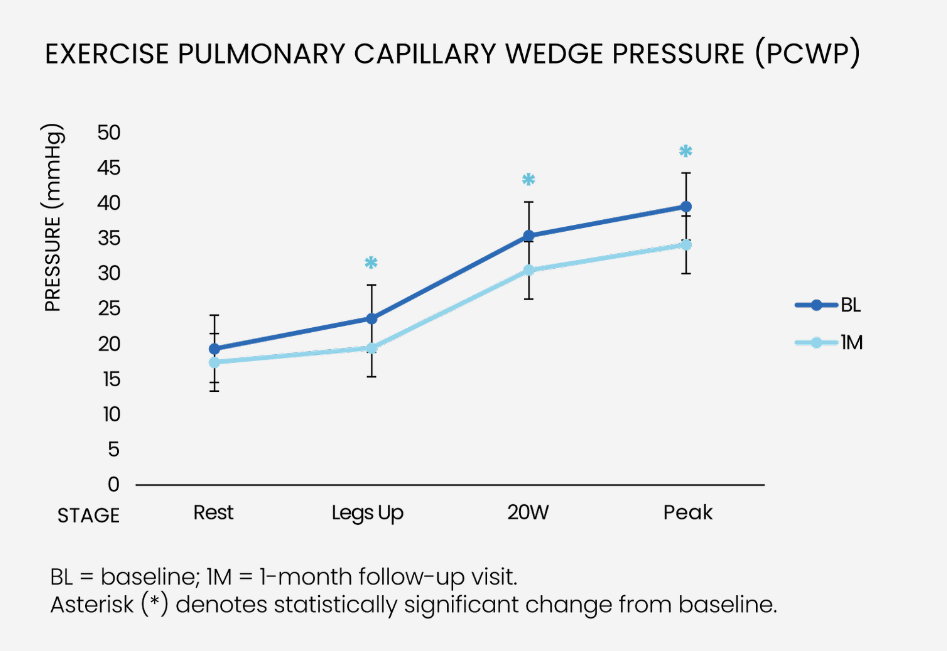
血流动力学测量值:峰值运动肺毛细血管楔压(PCWP)显著降低5.4毫米汞柱,有效缓解左心房压力升高的问题。
功能恢复:根据纽约心功能分级(NYHA) 的评估,在 6个月时,66.7%的患者 NYHA 分级至少改善 1个级别。
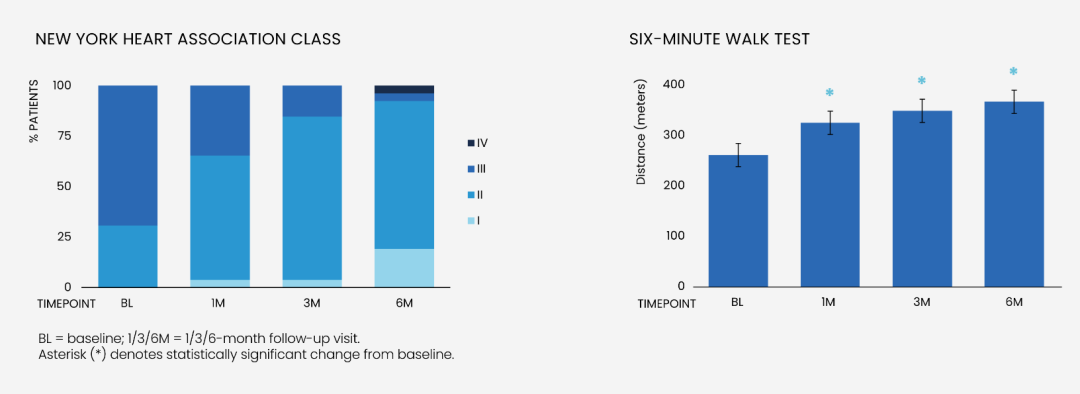
使用 六分钟步行测试(6MWT) 评估运动耐力,数据显示:患者平均步行距离增加了 37%(101米)。
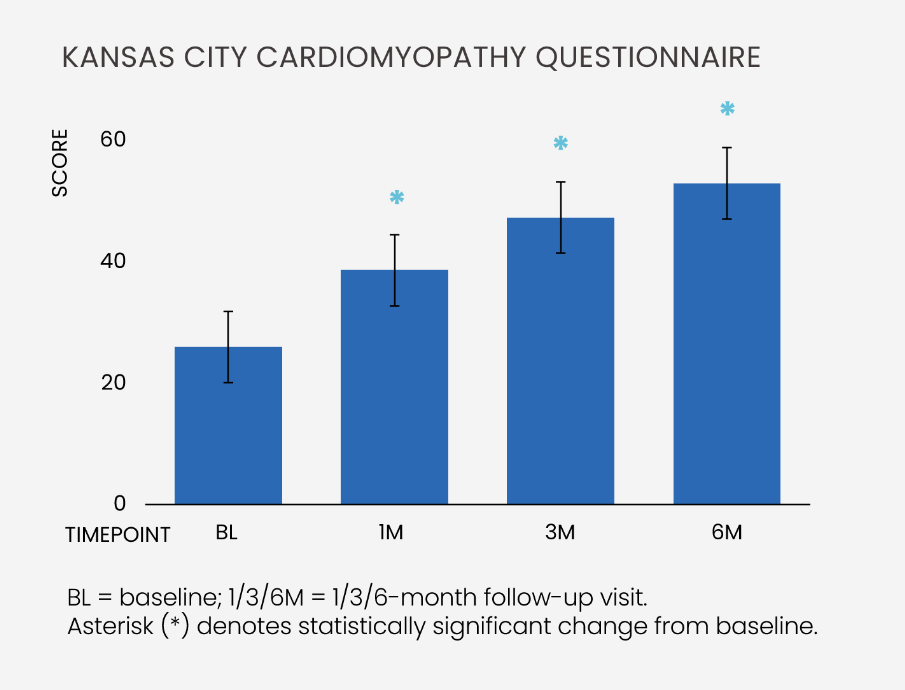
生活质量提升:使用堪萨斯城心肌病问卷(KCCQ) 评估,在 6个月时,患者总体评分提高了 83%,反映出症状减轻、身体功能增强及整体生活质量显著提升。
除了 HFpEF 试验 ALLAY-HF 之外,该公司还将启动 ALLAY-HFrEF 试验。
关于即将启动的ALLAY-HFrEF试验
目标患者:HFrEF患者(射血分数≤40%),在接受指南推荐的治疗后仍持续出现显著症状的群体。
研究计划:随机对照、自适应设计,在全球范围内招募350名患者。
时间安排:2025年初启动患者招募。
研究团队:由Gregg Stone博士(纽约西奈山医院),James Udelson博士(波士顿塔夫茨医学中心)共同领导。
研究目标:评估无植入心房分流装置的安全性和有效性,为未来FDA市场准入提供科学依据。
参考内容来源:
[1] Alleviant Medical Official Website. Alleviant Medical receives IDE and Breakthrough Device Designation for no-implant atrial shunt. Available at: https://www.alleviantmedical.com. Accessed January 7, 2025.
[2] Whooley, Sean. Alleviant Medical wins FDA IDE, breakthrough nods for no-implant heart failure treatment. MassDevice. Published January 7, 2025. Available at: https://www.massdevice.com.
关于我们
索特医疗是一家国际化医疗器械 CDMO 公司,拥有成熟的全球研发和制造网络。公司在爱尔兰和美国设有研发中心,在亚太地区设有大型制造中心。索特专注于导管、导丝、医用内窥镜、手术机器人和其他产品领域,在心脑血管以及消化、呼吸和其他临床领域创新产品的设计、开发和生产方面积累了丰富的经验。我们利用充分协同的网络,为全球医疗设备制造商提供最具经济效益和响应速度的服务。